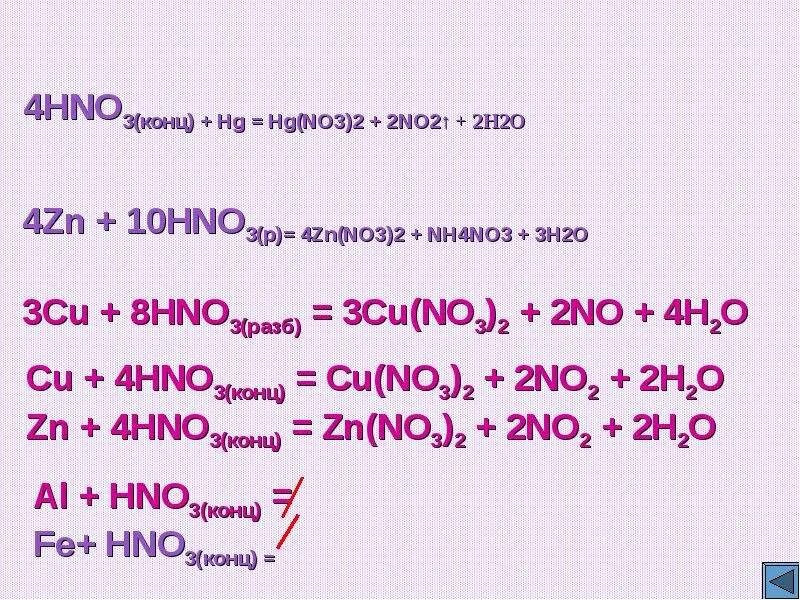
 2) pb(no3)2 + (nh4)s =. Kno2 получение. Fe+o2 овр. Взаимодействие цинка с азотной кислотой. X2 no3 3.
2) pb(no3)2 + (nh4)s =. Kno2 получение. Fe+o2 овр. Взаимодействие цинка с азотной кислотой. X2 no3 3.
|
 Hno3 fe no3 3 no h2o. (nh4)2so4 + agno3. Ch3no2 ch3nh2. Fe2o3 hno3 уравнение. Kn03 kno2+o2 овр.
Hno3 fe no3 3 no h2o. (nh4)2so4 + agno3. Ch3no2 ch3nh2. Fe2o3 hno3 уравнение. Kn03 kno2+o2 овр.
|
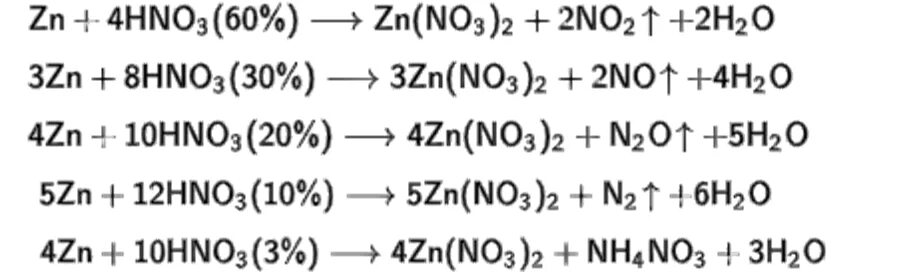 Ch3-nh2-ch3. Hno3 конц cus = s + no2. Fe2o3 hno3 уравнение. X2 no3 3. Из nh3 no2.
Ch3-nh2-ch3. Hno3 конц cus = s + no2. Fe2o3 hno3 уравнение. X2 no3 3. Из nh3 no2.
|
 Cu+4hno3 электронный баланс. X2 no3 3. Fe no3. X2 no3 3. Cu hno3 разб метод полуреакций.
Cu+4hno3 электронный баланс. X2 no3 3. Fe no3. X2 no3 3. Cu hno3 разб метод полуреакций.
|
 Kno3 kno2+o2 овр. Cu2s hno3. Nh4no3. X2 no3 3. Kno3 kno2 o2 расставить коэффициенты.
Kno3 kno2+o2 овр. Cu2s hno3. Nh4no3. X2 no3 3. Kno3 kno2 o2 расставить коэффициенты.
|
 Cu hno3 конц. Cu+hno3 cu(no3) окислительно восстановительная. Nh3 no2. X2 no3 3. X2 no3 3.
Cu hno3 конц. Cu+hno3 cu(no3) окислительно восстановительная. Nh3 no2. X2 no3 3. X2 no3 3.
|
 Kno3 kno2+o2 овр. Ca+hno3=no2. X2 no3 3. Nh3 no2. Nh4no3 из nh3.
Kno3 kno2+o2 овр. Ca+hno3=no2. X2 no3 3. Nh3 no2. Nh4no3 из nh3.
|
 Овр mg+hno3 - mg(no3)2 +no2+h2o. Nh3 no no2 hno3. Nh4 hno3 nh4no3. Fe hno3 fe no3 3 no2 h2o. Nh4 + no3 = nh4no3.
Овр mg+hno3 - mg(no3)2 +no2+h2o. Nh3 no no2 hno3. Nh4 hno3 nh4no3. Fe hno3 fe no3 3 no2 h2o. Nh4 + no3 = nh4no3.
|
![Feo hno3 fe no3 3 no h2o окислительно восстановительная реакция. Сн3-nh-ch3. Fe hno3 fe no3 3 no h2o электронный баланс. [ag(nh3)2]no3. H2o2 + kno2 = kno3 + h2o овр. Feo hno3 fe no3 3 no h2o окислительно восстановительная реакция. Сн3-nh-ch3. Fe hno3 fe no3 3 no h2o электронный баланс. [ag(nh3)2]no3. H2o2 + kno2 = kno3 + h2o овр.](https://avatars.mds.yandex.net/i?id=9e4aded33bef618fe669a2b2956c0592_l-5544440-images-thumbs&n=13) Feo hno3 fe no3 3 no h2o окислительно восстановительная реакция. Сн3-nh-ch3. Fe hno3 fe no3 3 no h2o электронный баланс. [ag(nh3)2]no3. H2o2 + kno2 = kno3 + h2o овр.
Feo hno3 fe no3 3 no h2o окислительно восстановительная реакция. Сн3-nh-ch3. Fe hno3 fe no3 3 no h2o электронный баланс. [ag(nh3)2]no3. H2o2 + kno2 = kno3 + h2o овр.
|
 X2 no3 3. Nh4no3 получить no2. X2 no3 3. Nh4no3 из nh3. Fe no3 2.
X2 no3 3. Nh4no3 получить no2. X2 no3 3. Nh4no3 из nh3. Fe no3 2.
|
 Cu2s hno3 конц. X2 no3 3. Получение no2. Kno2 kclo3 электронный баланс. X2 no3 3.
Cu2s hno3 конц. X2 no3 3. Получение no2. Kno2 kclo3 электронный баланс. X2 no3 3.
|
 Cu hno3 cu no3 2 h2o no2 степень окисления. 4mg +10hno4-4mg(no3)2+n2o. Zn hno3 разб. Zn+hno3 окислительно восстановительная реакция. Hg → hg(no3)2.
Cu hno3 cu no3 2 h2o no2 степень окисления. 4mg +10hno4-4mg(no3)2+n2o. Zn hno3 разб. Zn+hno3 окислительно восстановительная реакция. Hg → hg(no3)2.
|
 Cu+hno3 разб овр. Ag+nh4no3. Agno3 hno3 разбавленная. X2 no3 3. X2 no3 3.
Cu+hno3 разб овр. Ag+nh4no3. Agno3 hno3 разбавленная. X2 no3 3. X2 no3 3.
|
 X2 no3 3. Zn hno3 zn no3 2 nh4no3 h2o овр. N2+h2 овр. X2 no3 3. Fe3o4 реакции.
X2 no3 3. Zn hno3 zn no3 2 nh4no3 h2o овр. N2+h2 овр. X2 no3 3. Fe3o4 реакции.
|
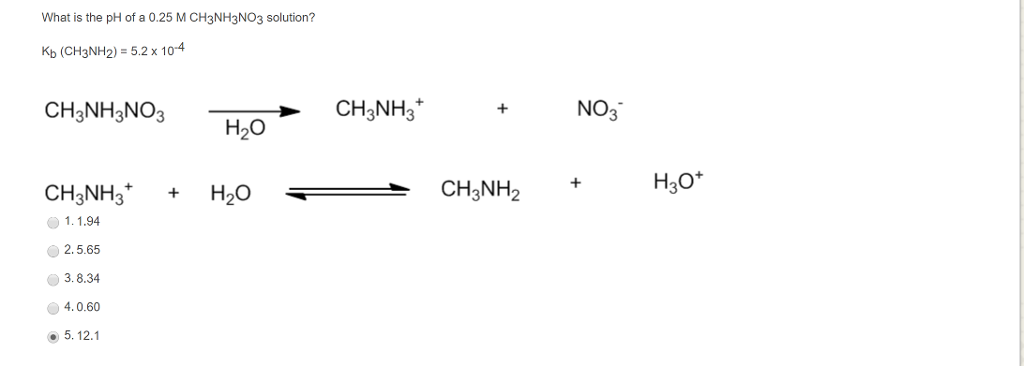 Карбонат аммония (nh4)2co3. Реакция цинка с разбавленной азотной кислотой. 2hgo 2hg o2 тип реакции. X2 no3 3. X2 no3 3.
Карбонат аммония (nh4)2co3. Реакция цинка с разбавленной азотной кислотой. 2hgo 2hg o2 тип реакции. X2 no3 3. X2 no3 3.
|
 X2 no3 3. Kno3 kno2 o2 окислительно восстановительная реакция. Zn hno3 конц. Fe(no3)3. N2+h2 окислительно восстановительная.
X2 no3 3. Kno3 kno2 o2 окислительно восстановительная реакция. Zn hno3 конц. Fe(no3)3. N2+h2 окислительно восстановительная.
|
 Цинк плюс hno3. Fe(oh)3. Ch3nh2. K2cr2o7 окислитель. No2-nh3-no-no2 - hno3.
Цинк плюс hno3. Fe(oh)3. Ch3nh2. K2cr2o7 окислитель. No2-nh3-no-no2 - hno3.
|
 X2 no3 3. Kno3 kno2+o2 овр. Nh4 hno3 nh4no3. Cu+hno3 разб овр. Cu+hno3 cu(no3) окислительно восстановительная.
X2 no3 3. Kno3 kno2+o2 овр. Nh4 hno3 nh4no3. Cu+hno3 разб овр. Cu+hno3 cu(no3) окислительно восстановительная.
|
 Kno2 получение. Cu hno3 разб метод полуреакций. Из nh3 no2. Fe hno3 fe no3 3 no h2o электронный баланс. Kno3 kno2+o2 овр.
Kno2 получение. Cu hno3 разб метод полуреакций. Из nh3 no2. Fe hno3 fe no3 3 no h2o электронный баланс. Kno3 kno2+o2 овр.
|
 Cu2s hno3. Ca+hno3=no2. Cu+hno3 cu(no3) окислительно восстановительная. Получение no2. X2 no3 3.
Cu2s hno3. Ca+hno3=no2. Cu+hno3 cu(no3) окислительно восстановительная. Получение no2. X2 no3 3.
|
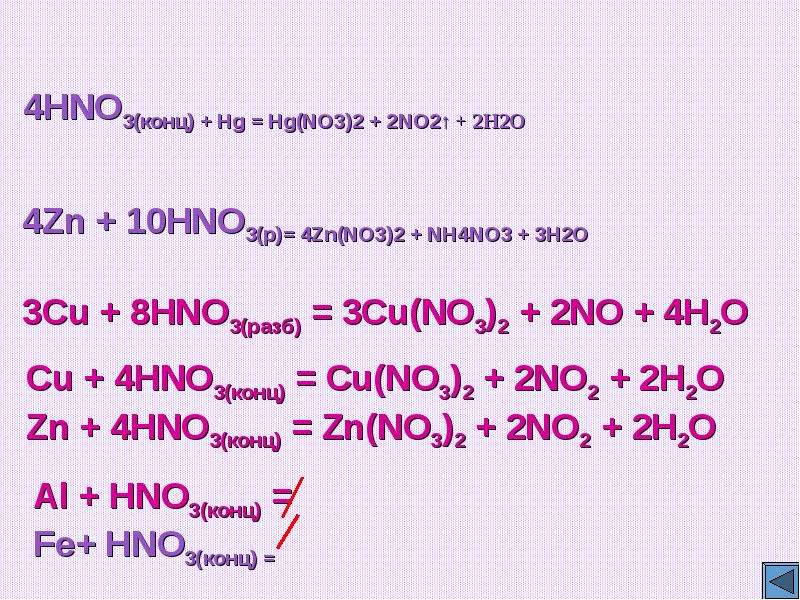

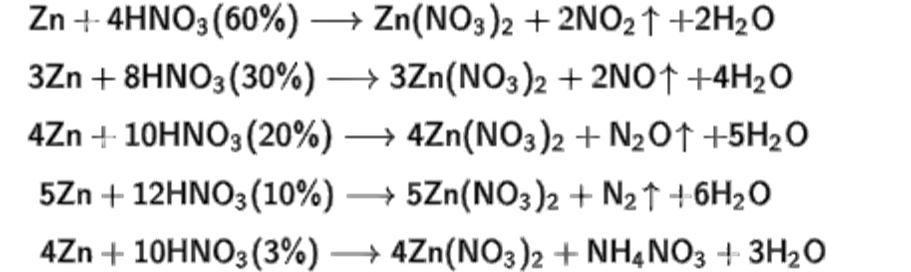





![Feo hno3 fe no3 3 no h2o окислительно восстановительная реакция. Сн3-nh-ch3. Fe hno3 fe no3 3 no h2o электронный баланс. [ag(nh3)2]no3. H2o2 + kno2 = kno3 + h2o овр. Feo hno3 fe no3 3 no h2o окислительно восстановительная реакция. Сн3-nh-ch3. Fe hno3 fe no3 3 no h2o электронный баланс. [ag(nh3)2]no3. H2o2 + kno2 = kno3 + h2o овр.](https://myslide.ru/documents_7/1f10f519832b1ef58641b7ad4eccc361/img26.jpg)

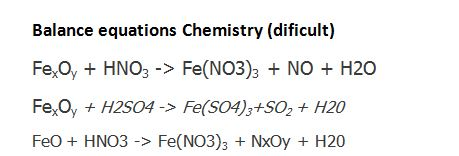

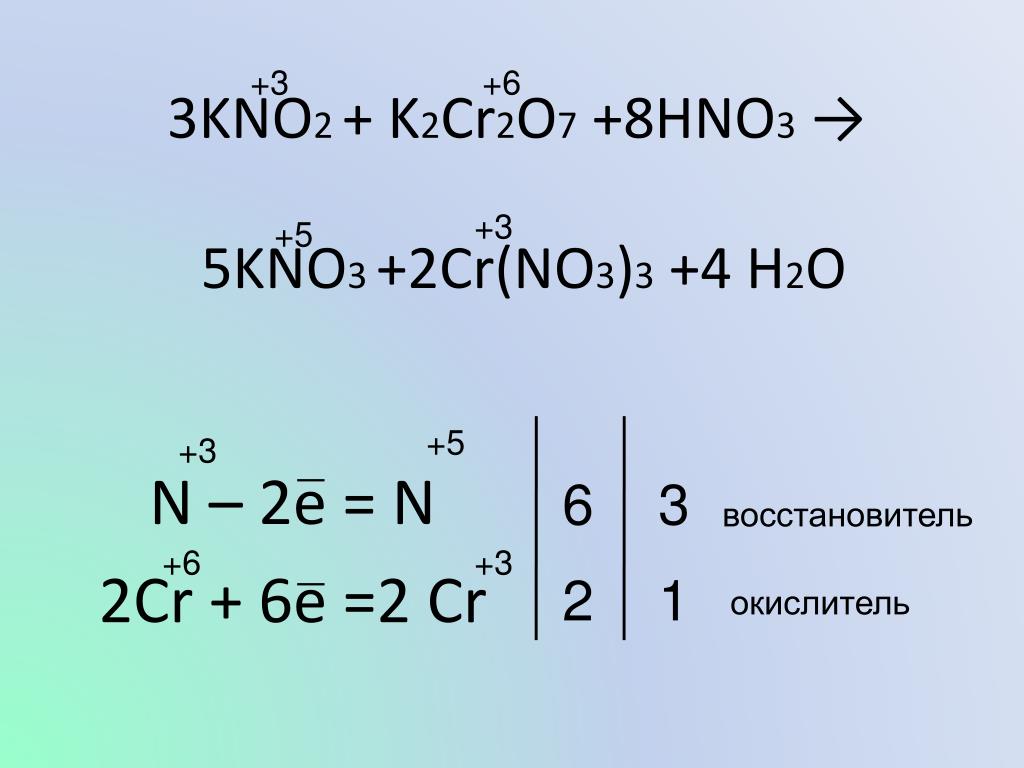


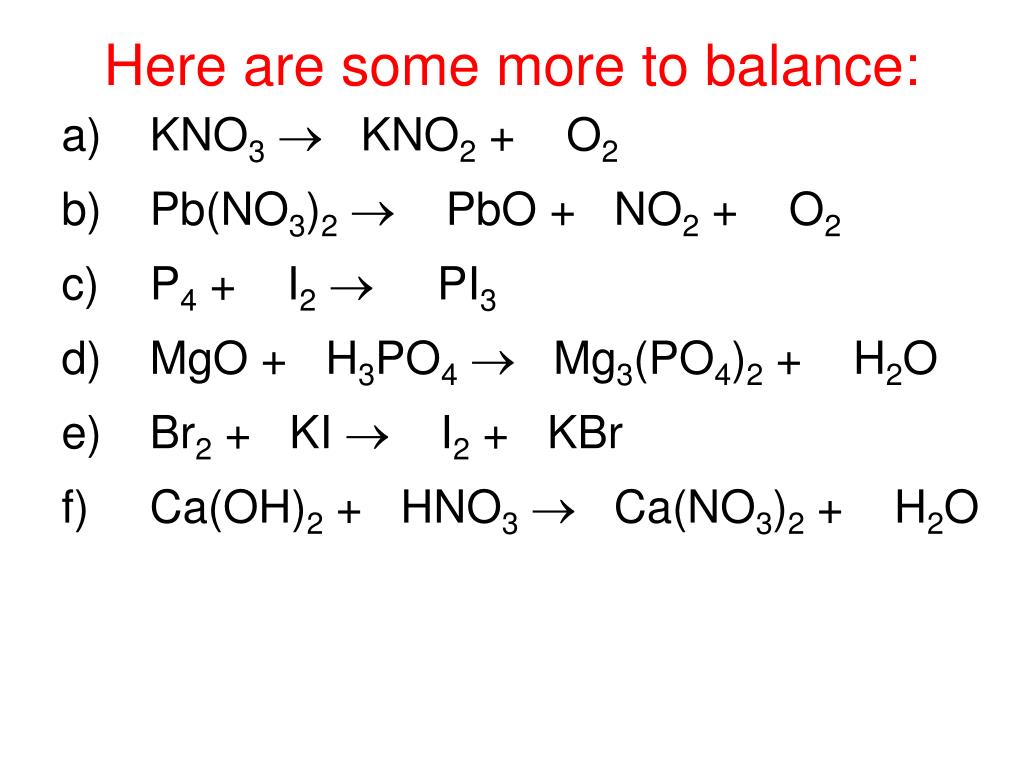



2%20+%20NO%20+%20H2O%20reaction.jpg)


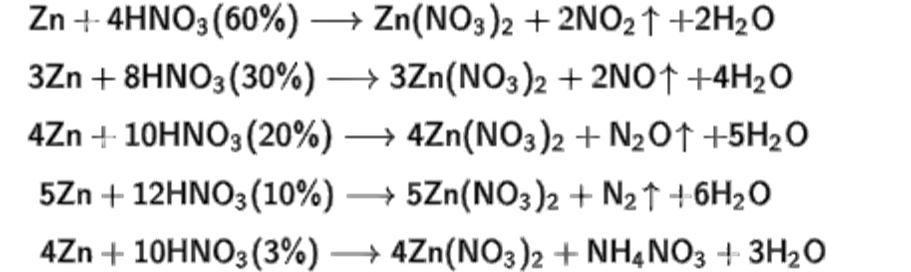





![Feo hno3 fe no3 3 no h2o окислительно восстановительная реакция. Сн3-nh-ch3. Fe hno3 fe no3 3 no h2o электронный баланс. [ag(nh3)2]no3. H2o2 + kno2 = kno3 + h2o овр. Feo hno3 fe no3 3 no h2o окислительно восстановительная реакция. Сн3-nh-ch3. Fe hno3 fe no3 3 no h2o электронный баланс. [ag(nh3)2]no3. H2o2 + kno2 = kno3 + h2o овр.](https://myslide.ru/documents_7/1f10f519832b1ef58641b7ad4eccc361/img26.jpg)

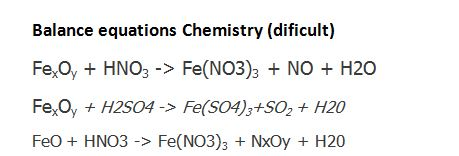








2%20+%20NO%20+%20H2O%20reaction.jpg)